AG Experimentelle Zinkforschung im Adaptiven Immunsystem
Beteiligte Mitarbeiterinnen und Mitarbeiter:
Univ.-Prof. Dr. rer. nat. Lothar Rink
Birgit Plümäkers (MTA)
Dagmar Marx
M. Sc. Nour Gammoh
M. Sc. Mary-Ann Puppa
M. Sc. Jana Wolf
cand. med. Stefanie Weisenfeld
cand. med. Bastian Baarz
cand. med. Anne Schmidt
cand. med. Vera Rodenkirchen
cand. med. Luisa Weidert
cand med. Ruojun Ding
cand. med. Wenlei Liu
cand. med. Sophie Dünkelberg
B. Sc. Sarah Trame
Allgemeine Thematik
Die Rolle von Zink in biologischen Systemen wurde in den vergangenen Jahren intensiv erforscht. Ergebnisse zeigen, dass insbesondere die Funktionalität des Immunsystems stark von einer ausgeglichenen Zinkhomeostase abhängt. Trotz großer Fortschritte in der Zinkforschung und einem grundlegenden Verständnis der Zinkhomeostase, sind auf diesem Gebiet noch viele Fragen offen. Vor allem die Quantifizierung des intrazellulären Zinkgehaltes verschiedener Organe und Zelltypen, krankhafte Veränderungen der Zinkhomeostase und auch die Rolle von Zink in intrazellulären Signalwegen sind Gegenstand der derzeitigen Forschung. Die Messung des intrazellulären Zinkgehaltes ist jedoch schwierig und fehleranfällig, da die Zinkkonzentrationen extrem gering sind (pico- bis nanomolarer Bereich). Vorhandene Methoden bedienen sich fluoreszierender Sonden und Sensoren.
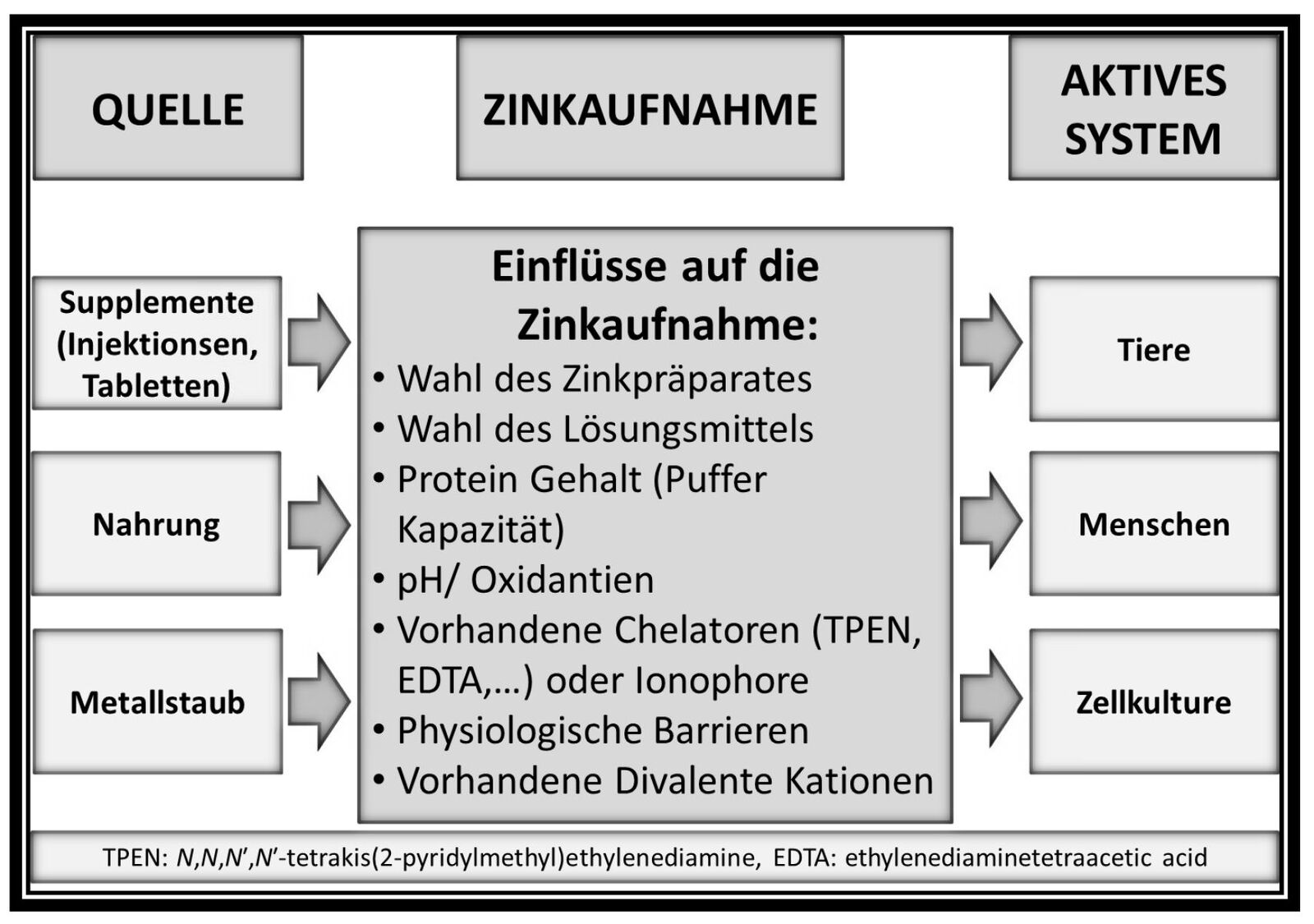
Zinkdefizienz ist ein globales Problem und führt zu Todesfällen und Erkrankungen auf der ganzen Welt. Trotz dessen gibt es keinen verlässlichen Messparameter zur Bestimmung des menschlichen Zinkstatus. Die Arbeit mit Zink ist weder in vivo als auch in vitro nicht trivial. Problematiken sind in Abbildung 1 angedeutet und wurden in einem kürzlich veröffentlichten Artikel ausgiebig beschrieben (Ollig et al., 2016). Auch die Supplementierung mit Zink ist komplex, da die Aufnahme von Zink in den Körper von verschiedensten Faktoren abhängt, zu denen beispielsweise die Anwesenheit von zinkbindenenden Phytaten, die Wahl des Zinkpräparates und seine Darreichungsform gehören.
Neben der Erforschung der Rolle von Zink im Immunsystem beschäftig sich die Forschung an unserem Institut deshalb auch mit der Optimierung der Messung von Zink in vitro. Analysen zur Aufnahme neu entwickelter Zinkpräparate gehören ebenfalls zur aktuellen Forschungsthematik.
Projekte
1. Einfluss von Zink auf IL-2-Produktion durch T-Zellen
2. Einfluss von Zink auf Antigenprozessierung und -präsentation durch MHC-II
3. Zink in der Transplantationsmedizin
4. Zink und NK-Zellen
5. Entwicklung eines biochemisch validen Fragebogens und Normierung des Biomarkers Serumzink zur Bestimmung des Zinkversorgungsstatus beim gesunden Menschen
Beendete Projekte
1. Mycoplasma arthritidis Superantigen
Mycoplasma arthritidis erzeugt in Nagetieren eine Polyarthritis und wird als ein möglicher Erreger der rheumatoiden Arthritis (RA) beim Menschen diskutiert. Aufgrund von Verschiebungen im T-Zell-Repertoire werden Superantigene mit verschiedenen Autoimmunkrankheiten in Verbindung gebracht. Das Mycoplasma arthritidis Superantigen (MAS) ist das einzige Superantigen aus Mycoplasmen. Im vergangenen Antragszeitraum haben wir mit CD-Spektren gezeigt, das rekombinantes MAS aufgrund seines hohen α-Helix Anteils im Protein nicht das für Superantigene charakteristische Motiv bilden kann. Damit hat MAS eine vollkommen neue Superantigenstruktur. Deswegen soll die 3-dimensionale Struktur von MAS gelöst werden. Es wird parallel versucht die NMR- bzw. Röntgenstruktur zu lösen, um als erste Arbeitsgruppe dieses neue Superantigenmotiv zu charakterisieren. In den Vorarbeiten wurde das HLA-abhängige MAS-induzierte Vβ-Repertoire mittels Vβ-transfizierten T-Zellen teilweise charakterisiert, was abgeschlossen werden soll. Erste Versuche zeigen, dass MAS trotz unterschiedlicher Struktur zumindest die selbe Zink-abhängige Bindungsstelle an der HLA-DR β-Kette verwendet, während die α-Bindungsstelle neuartig zu sein scheint. Die Bindungsstellen von MAS am HLA-DR und am T-Zell-Rezeptor (TCR) sollen auf molekularer Ebene charakterisiert werden. Hierfür stehen sowohl Mutanten von HLA-DR zur Verfügung, die in den klassischen Superantigenbindungsstellen an der α- und β-Kette mutiert sind, als auch Vβ-transfizierte T-Zellen. Unterstützt werden die Untersuchungen durch Mutationen im Superantigen selbst. Hierbei soll auch die Frage geklärt werden, über welche Kette des HLA-DR-Moleküls das Superantigen an bestimmte Vβ-Elemente präsentiert wird, was aufgrund des unterschiedlichen Polymorphismus eine große immunologische Relevanz hat. Des weiteren soll die Frage geklärt werden, ob die Bindung von MAS vom Peptid im HLA-DR-Komplex beeinflusst wird, wie dies beim Superantigen TSST-1 der Fall ist. In den Vorarbeiten konnte eine erhöhte MAS-Reaktivität von Leukocyten von Patienten mit RA bzw. Morbus Bechterew (MB) herausgearbeitet werden. Außerdem zeigte MAS eine erhöhte Reaktivität mit bestimmten HLA-DR-Typen, die gleichzeitig mit RA assoziiert sind. In Seren von RA-Patienten wurden zudem Antikörper gefunden, die MAS erkennen. Um die Rolle von Mycoplasma arthritidis bzw. MAS bei RA und MB weiter zu kären, sollen die Epitope der MAS-reaktiven Antikörper in diesen Seren charakterisiert werden.
2. MHC-II Signaltransduktion
Die Interaktion zwischen den Molekülen des Haupthistokompatibilitätskomplexes (MHC) und dem T-Zell-Rezeptor (TCR) ist das zentrale Ereignis der spezifischen Immunantwort. Die Signaltransduktion über den TCR ist weitestgehend bekannt. Über die Signaltransduktion der MHC-II-Moleküle weiß man wenig. Es ist jedoch Fakt, dass der intrazelluläre Teil der MHC-II-Moleküle nicht zur Signaltransduktion ausreicht. Bakterielle Superantigene sind Toxine, die die Interaktion zwischen MHC und TCR optimal nachahmen. Hierdurch werden akute und chronische Entzündungsprozesse ausgelöst. Einige Superantigene wie das Staphylokokken Enterotoxin A besitzen zwei unabhängige Bindungsstellen für MHC-II-Moleküle. Diese bivalenten Superantigene können MHC-II-positive Zellen unabhängig von T-Zellen direkt aktivieren. Die T-Zell-unabhängige MHC-II-Signaltransduktion ist zum einen ein experimentelles Modell für die Signalübermittlung durch MHC-II generell, zum anderen stellt sie einen neuen Pathogenitätsmechanismus der Superantigene dar.
In den Vorarbeiten wurde erstmals die MHC-II-Signaltransduktion in reinen neutrophilen Granulozyten nachgewiesen. Durch Inhibitionsversuche mit Antikörpern konnte eine Beteiligung der Adhäsionsmolekülketten CD11a und CD18 an der MHC-II-Signaltransduktion gezeigt werden. Des Weiteren wurde ein kovalent verbundenes Superantigendimer charakterisiert.
Im vorliegenden Projekt soll durch Blockierung mit Fab-Fragmenten gegen Adhäsionsmoleküle weiter untersucht werden, welche akzessorischen Moleküle für die MHC-II-Signaltransduktion notwendig sind. Die identifizierten akzessorischen Moleküle sollen mit MHC-II coexprimiert werden, damit ihre Signalwege im Detail untersucht werden können, und damit die minimale Signaleinheit für die MHC-II-Signaltransduktion definiert werden kann. Außerdem soll untersucht werden, warum bei der MHC-II-Signaltransduktion durch Superantigene in den aktivierten Zellen nur proinflammatorische Zytokine wie Interleukin (IL)-1 und IL-6 induziert werden, jedoch nicht wie bei der Induktion durch andere bakterielle Substanzen (z.B. Lipopolysaccharid) auch antiinflammatorische Zytokine wie IL-10 und der IL-1RA (Rezeptorantagonist). Den Schwerpunkt bildet hierbei die fehlende IL-1RA-Induktion. Hierfür soll untersucht werden, welche Transkriptionsfaktoren durch die MHC-II-Signaltransduktion aktiviert werden, und welche Zytokine, die sekundär IL-1RA induzieren, nicht produziert werden. Diese Arbeiten können Mechanismen bei Superantigen-induzierten Krankheiten klären und die Potenz der Superantigene zur Induktion einer chronischen Entzündung zeigen.
3. Streptokokken Superantigene
Das Spektrum der durch S. pyogenes verursachten Erkrankungen ist beachtlich. Dies ist darauf zurückzuführen, dass sich S. pyogenes einer Vielzahl pathogener Mechanismen, deren genauer Ablauf größtenteils noch unbekannt ist, bedient. Einen der Pathomechanismen stellt die Bildung von Superantigenen aus S. pyogenes (z. B. SPEA, SPEC) dar. Dieser Pathomechanismus lässt sich in verschiedene Funktionsprinzipien unterteilen. Die Superantigene treten außer in ihrer monomeren Form als kovalent gebundene (SPEA) und als nicht-kovalent gebundene (SPEC) Homodimere auf. Im Rahmen des beantragten Projektes sollen die von S. pyogenes produzierten Superantigen-Dimere hinsichtlich ihrer Funktionalität in Abgrenzung von den Monomeren untersucht werden. Des Weiteren soll geprüft werden, ob unter physiologischen Bedingungen die Bildung von SPEA-SPEC-Heterodimeren auftritt. Der Nachweis einer Heterodimerisierung von SPEA und SPEC würde einen wesentlichen Fortschritt im Verständnis der Wirkmechanismen von Superantigenen aus S. pyogenes darstellen und damit dazu beitragen, die Pathogenese der mannigfaltigen Erkrankungen durch diesen Erreger zu verstehen. Darüber hinaus würde damit erstmalig die Heterodimerisierung von Superantigenen und somit ein völlig neuartiger Wirkmechanismus dieser Proteinfamilie nachgewiesen.
Weiteren Aufschluss über die durch Superantigene induzierten Pathomechanismen von S. pyogenes wird durch die Stammanalyse von Patientenisolaten aus dem Nationalen Referenzzentrum für Streptokokken erwartet. Im Rahmen des Projektes sollen die konservierten Stämme hinsichtlich ihrer Superantigen-Produktion gescreent werden. Bei den positiven Stämmen soll eine Differenzierung hinsichtlich der Freisetzung von Monomeren, Homodimeren und möglicherweise Heterodimeren erfolgen. Der Abgleich der Ergebnisse dieser Stammanalyse mit den klinischen Daten kann wichtige Aufschlüsse über den Zusammenhang zwischen dem durch die verschiedenen S. pyogenes-Superantigen-Formen induzierten Pathomechanismus und dem Krankheitsbild geben.
Die Aufklärung der dargestellten Struktur-Funktionsbeziehungen kann nicht nur entscheidend zum Verständnis des Funktionsprinzips von Superantigenen aus S. pyogenes beitragen, sondern auch zu dem anderer Dimer-bildender Superantigene. Durch die Aufklärung einzelner Pathomechanismen bakterieller Virulenz können neue Anregungen für Möglichkeiten zur Prophylaxe bzw. für Therapien gegeben werden.








