Forschung
Fetuine und verwandte Proteine
Fetuin-A/alpha-2-Heremans Schmid-glycoprotein (FETUA/AHSG), Fetuin-B (FETUB), Histidine-reiches Glycoprotein (HRG) and Kininogen (KNG) sind Mitglieder der Cystatin-Superfamilie, einer Untergruppe der Cystein-Proteinaseinhibitoren. Sie bilden die so genannten Typ 3 Mitglieder, die alle in der Leber synthetisiert und ins Blut sezerniert werden. Alle Typ 3 Cystatine haben mehrere Disulfid-Brücken. Jedes Protein ist von einem einzigen Gen codiert. Die Gene liegen in unmittelbarer Nachbarschaft in allen bekannten Vertebraten-Genomen und sind eng verwandt. Abbildung 1 zeigt schematisch die Proteinstruktur der Typ 3-Cystatine.
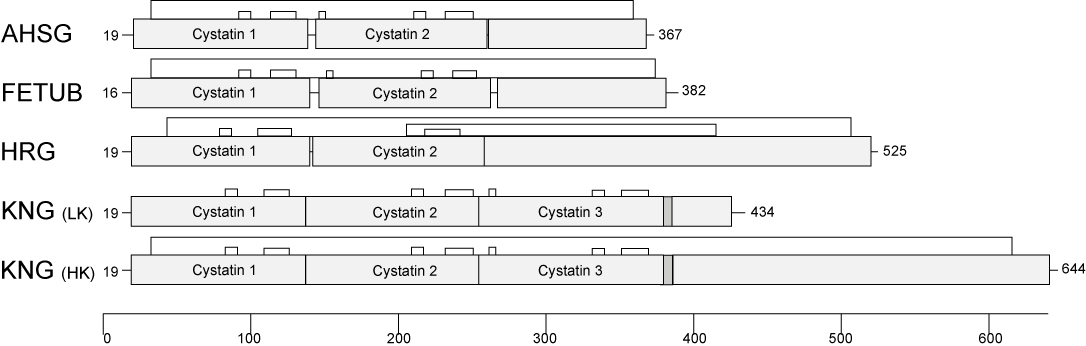
Die Fetuin-Gene entstanden durch Duplikation von Cystatin-Proteindomänen und Fusion mit weiteren stabilen Geneinheiten. Die Kombination von stabilen und in der Evolution konservierten Protein-Bausteinen brachte Proteine hervor, die zwar ganz ähnlich aufgebaut sind, aber vollkommen verschiedene Funktionen haben. Das läßt sich am besten am Beispiel der Proteine Fetuin-A und Fetuin-B erklären. Beide Proteine haben drei Domänen, sind ähnlich gross, werden hauptsächlich in der Leber gemacht und werden ins Blut sezerniert. Durch genetische Untersuchungen an Mausstämmen, denen gezielt die jeweiligen Gene entfernt wurden, durch sog. knockout-Mäuse fanden wir heraus, dass Fetuin-A hauptsächlich dafür verantwortlich ist, den Transport und die Stabilität von Mineral im Körper zu bewerkstelligen, wohingegen Fetuin-B hochspezifisch sog. Zink-Metalloproteinasen hemmt. Die Knockout-Mäuse zeigen trotz der engen Verwandschaft der Proteine daher frappierend unterschiedliche Phänotypen, d. h. der Mangel an Fetuin-A und Fetuin-B hat völlig unterschiedliche Konsequenzen. Fetuin-A knockout-Mäuse zeigen im ganzen Körper Kalkablagerungen, die mit zunehmendem Alter zu Einschränkungen der Organfunktionen führen, während Fetuin-B knockout-Mäuse als Weibchen komplett infertil sind, weil die Hülle der Eizellen dieser Weibchen bereits vor der Befruchtung verhärten und dadurch die Befruchung verhindern.
Neben diesen klar nachweisbaren Funktionen haben beide Proteine vermutlich noch andere, nachgeordnete Funktionen, die anderen Orts in den Vordergrund gestellt werden, sich aber in den Knockout-Mäusen nicht nachweisen lassen. Das heisst nicht, dass derlei Funktionen nicht im Experiment beobachtet werden können, nur sind sie im Gegensatz zu den gerade geschilderten Funktionen nicht durchgehend durch genetische, biochemische, molekularbiologische und klinische Studien belegbar, sondern häufig nur durch Einzelbeobachtung an ausgewählten experimentellen Systemen.
Einführungen in die Funktion und Wirkweise der Fetuin-Proteine finden sich in den nachfolgend aufgeführten Übersichtsartikeln und der darin zitierten Literatur, sowie in der Literaturliste, die sich beim Anklicken des Menüpunkts "Publikationen" öffnet. Weitere Details unter "Biomineralisation" und "Reproduktionsbiologie" auf der Startseite. Viel Spaß beim Lesen!
Übersichtsartikel
Type 3 cystatins; fetuins, kininogen and histidine-rich glycoprotein.
Lee C, Bongcam-Rudloff E, Sollner C, Jahnen-Dechent W, Claesson-Welsh L.
Front Biosci (Landmark Ed). 2009 Jan 1;14:2911-22. Review.
PMID: 19273244
Nature's remedy to phosphate woes: calciprotein particles regulate systemic mineral metabolism.
Jahnen-Dechent W, Smith ER.
Kidney Int. 2020 Apr;97(4):648-651. doi: 10.1016/j.kint.2019.12.018. PMID: 32200857
Fetuin-A regulation of calcified matrix metabolism.
Jahnen-Dechent W, Heiss A, Schäfer C, Ketteler M.
Circ Res. 2011 Jun 10;108(12):1494-509. doi: 10.1161/CIRCRESAHA.110.234260. Review. PMID: 21659653
Structure of mammalian plasma fetuin-B and its mechanism of selective metallopeptidase inhibition.
Cuppari A, Körschgen H, Fahrenkamp D, Schmitz C, Guevara T, Karmilin K, Kuske M, Olf M, Dietzel E, Yiallouros I, de Sanctis D, Goulas T, Weiskirchen R, Jahnen-Dechent W, Floehr J, Stoecker W, Jovine L, Gomis-Rüth.
FX.IUCrJ. 2019 Feb 28;6(Pt 2):317-330. doi: 10.1107/S2052252519001568. eCollection 2019 Mar 1. PMID: 30867929
Fetuin-B, a liver-derived plasma protein is essential for fertilization.
Dietzel E, Wessling J, Floehr J, Schäfer C, Ensslen S, Denecke B, Rösing B, Neulen J, Veitinger T, Spehr M, Tropartz T, Tolba R, Renné T, Egert A, Schorle H, Gottenbusch Y, Hildebrand A, Yiallouros I, Stöcker W, Weiskirchen R, Jahnen-Dechent W.
Dev Cell. 2013 Apr 15;25(1):106-12. doi: 10.1016/j.devcel.2013.03.001. Epub 2013 Apr 4. PMID: 23562279
Biomineralisation und Calciprotein-Partikel
Die Minerale Calcium und Phosphat sind unverzichtbar für den zellulären Stoffwechsel aller Lebewesen. Calcium ist sowohl ein zellulärer Botenstoff als auch ein essenzieller Bestandteil in Knochen und Zähnen. Energiereiche Phosphate sind darüber hinaus maßgeblich am Energiestoffwechsel beteiligt und steuern die Wirkung signalisierender Moleküle. Beide Ionen kommen typischerweise in millimolarer Konzentration in biologischen Flüssigkeiten vor. Dadurch ergibt sich ein Löslichkeits- und Transportproblem, Calciumphosphate sind schwer wasserlöslich und scheiden leicht aus übersättigten Lösungen aus. Ein ähnliches Transportproblem gibt es bei Fetten, insbesondere bei Cholesterin, das ebenfalls in großer Menge im wässrigen Milieu des Blutes transportiert werden muss, aber nahezu unlöslich in Wasser ist. Werden Fette und Minerale mithilfe von Proteinen kolloidal stabilisiert, kann der Transport im Körper erfolgen.
Blut enthält also neben den Blutzellen gelöste Bestandteile sowie kolloidal stabilisierte Stoffe. Calciproteinpartikel (CPP) sind kolloidale Protein-Mineralkomplexe, die am Institut für Zell- und Molekularbiologie an Grenzflächen entdeckt wurden. CPP entstehen in proteinhaltigen Lösungen, die übersättigt sind mit Calcium und Phosphat. In einer protein- freien Lösung mit einem Überschuss an Calcium und Phosphat fällt sofort kristallines Calciumphosphat aus. Proteine in der Lösung binden kleinste Calciumphosphatkristalle und verhindern deren weiteres Wachstum, sodass die Lösung stabilisiert wird. Wir untersuchen die Bildung, Struktur und Funktion von Calciprotein-Partikeln in der Knochenmineralisierung und in pathologischer Verkalkung. Wir messen das Kalzifizierungs-Risiko in Patienten mit gestörtem Mineralhaushalt.
Literatur
Mud in the blood: the role of protein-mineral complexes and extracellular vesicles in biomineralisation and calcification.
Jahnen-Dechent W, Büscher A, Köppert S, Heiss A, Kuro-o M, Smith ER.
J Struct Biol. 2020;212:107577
Nature's remedy to phosphate woes: calciprotein particles regulate systemic mineral metabolism.
Jahnen-Dechent W, Smith ER.
Kidney Int. 2020 Apr;97(4):648-651.
Fetuin-A regulation of calcified matrix metabolism.
Jahnen-Dechent W, Heiss A, Schäfer C, Ketteler M.
Circ Res. 2011 Jun 10;108(12):1494-509.
Reproduktionsbiologie
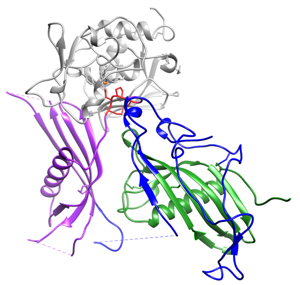
Das Plasmaprotein Fetuin-B ist essenziell für die Befruchtung von Säuger-Eizellen. Als Inhibitor der Eizell-spezifischen Proteinase Ovastacin erhält Fetuin-B die Befruchtungsfähigkeit der Eizelle. Fetuin-B defiziente Mäuse sind folglich infertil. Die Eizellen dieser Tiere zeigen eine vorzeitige Härtung der Zona Pellucida (Extrazellulärmatrix, die die Eizelle umgibt). Spermien können diese Eizelle deshalb nicht befruchten. Wir messen Fetuin-B Serumspiegel im Menschen und untersuchen im Mausmodell den Einfluss von Fetuin-B auf die Befruchtungsfähigkeit der Eizelle in vitro und in vivo. Durch Struktur-Analysen bestimmen wir die Domäne von Fetuin-B, die für die Inhibition von Ovastacin essenziell ist. So legen wir die Grundlage für mögliche Therapien von Patientinnen mit bisher ungeklärter Unfruchtbarkeit, als auch für mögliche nicht-hormonelle Verhütungsmittel.
Kürzlich klärten wir den genauen Interaktionsmechanismus von Fetuin-B und Ovastacin an einem 3-dimensionalen Strukturmodell auf.
Literatur
Structure of mammalian plasma fetuin-B and its mechanism of selective metallopeptidase inhibition.
Cuppari A, Körschgen H, Fahrenkamp D, Schmitz C, Guevara T, Karmilin K, Kuske M, Olf M, Dietzel E, Yiallouros I, de Sanctis D, Goulas T, Weiskirchen R, Jahnen-Dechent W, Floehr J, Stoecker W, Jovine L, Gomis-Rüth.
FX.IUCrJ. 2019 Feb 28;6(Pt 2):317-330. doi: 10.1107/S2052252519001568. eCollection 2019 Mar 1. PMID: 30867929
Fetuin-B, a liver-derived plasma protein is essential for fertilization.
Dietzel E, Wessling J, Floehr J, Schäfer C, Ensslen S, Denecke B, Rösing B, Neulen J, Veitinger T, Spehr M, Tropartz T, Tolba R, Renné T, Egert A, Schorle H, Gottenbusch Y, Hildebrand A, Yiallouros I, Stöcker W, Weiskirchen R, Jahnen-Dechent W.
Dev Cell. 2013 Apr 15;25(1):106-12. doi: 10.1016/j.devcel.2013.03.001. Epub 2013 Apr 4. PMID: 23562279
Tissue Engineering
Materialien, die im und am menschlichen Körper zum Einsatz kommen heißen Biomaterialien. Je nach geplantem Zweck sollen diese Materialien inert sein, also möglichst keine Reaktionen des umgebenden Gewebes hervorrufen, oder sie sollen die umgebenden Zellen gezielt in eine vorbestimmte Richtung dirigieren. Wir untersuchen Zell/Biomaterial-Interaktionen, um geeignete Kombinationen für den Bereich Knochenersatz und kardiovaskuläres Tissue Engineering zu identifizieren und zu optimieren. Zum Einsatz als Biomaterialien kommen vorwiegend Polymere und Keramiken. Als Hauptzelltyp setzen wir adulte, multipotente mesenchymale Stammzellen ein, die in Knochen- und glatte Muskelzellen differenzieren. Daneben produzieren mesenchymale Stammzellen Zytokine und Wachstumsfaktoren, die Wundheilungs- und Regenerationsprozesse unterstützen.
Mesenchymale Stammzellen
Mesenchymale Stammzellen (MSC) sind adulte, multipotente Stammzellen, die man aus verschiedenen Geweben wie Knochenmark, Nabelschnurmatrix, Fettgewebe und Plazenta isolieren und in vitro differenzieren kann. Sie besitzen ein Selbsterneuerungs- sowie ein Differenzierungspotential und lassen sich in vitro z.B. in Knochen-, Knorpel- und Fettzellen differenzieren. Neben Proliferation und Differenzierung können sie über die Sekretion von Zytokinen an verschiedenen Prozessen (Angiogenese, Fibrose, Extrazellulärmatrix-Remodelling) teilnehmen und die Immunantwort regulieren. Diese Eigenschaften machen MSC zu einem vielversprechenden Zelltyp für die Regenerative Medizin und Tissue Engineering Anwendungen.
Biomaterialien
Die klassische Einteilung von Biomaterialien erfolgt in die drei Bereiche der Keramiken, Metalle und Polymere. Die Auswahl möglicher einsetzbarer Biomaterialien für medizinische Zwecke ist nahezu unbegrenzt. Wichtig ist jedoch, dass ein Biomaterial auch biokompatibel ist. Unter Biokompatibilität versteht man, dass ein Biomaterial an einer bestimmten Stelle am oder im Körper eine ganz spezielle Funktion erfüllt, für die mit dem Material in Kontakt tretenden Zellen nicht toxisch ist und keine größere Entzündungs- oder Abstoßungsreaktion hervorruft. In vitro kann initial nur eine Zytokompatibilität, also die Kompatibilität eines Materials mit einem bestimmten Zelltyp bzw. das Gegenteil, die Zytotoxizität ermittelt werden. Die Analysen erfolgen meist in Anlehnung an die ISO-Norm 10993-5 „Prüfung auf in vitro-Zytotoxizität“. Der Einfluss von Biomaterialien auf einen bestimmten Zelltyp kann durch verschiedenste Parameter hervorgerufen und gesteuert werden. Neben der Materialchemie ist die Materialoberfläche von zentraler Bedeutung. Die Oberflächenchemie und –physik steuern die Benetzbarkeit (hydrophobe/hydrophile Materialien), die Oberflächenladung und die elektrische Leitfähigkeit. Die Oberflächentopographie kann ebenfalls einen starken Einfluss auf adhärente Zellen ausüben.
MSC/Biomaterial-Interaktionen
Prinzipiell gibt es zwei mögliche wünschenswerte Ziele, entweder die MSC proliferieren auf dem Biomaterial ohne zu differenzieren oder aber das Material unterstützt eine bestimmte Differenzierungsrichtung der MSC bzw. steuert diese sogar, ohne dass weitere Differenzierungsfaktoren hinzugegeben werden.
Neben der iterativen Analyse des Zellverhaltens auf einzelnen Biomaterialien gab es im letzten Jahrzehnt Entwicklungen im Bereich Hochdurchsatzanalyse zur Untersuchung von Zell/Biomaterial-Interaktionen. Biomaterial-Chips stellen heutzutage ein geeignetes Werkzeug dar, um simultan eine große Menge an Proben zu analysieren, mit dem Ziel, geeignete Kombinationen von Zellen und Biomaterialien für z.B. Tissue Engineering Anwendungen zu identifizieren.
Tissue Engineering
Unter Tissue Engineering versteht man ein interdisziplinäres Forschungsgebiet, das Prinzipien aus Natur- und Ingenieurwissenschaften vereint, um künstliche Organe oder Gewebeersatzsysteme zur Unterstützung bzw. Substitution von kranken Geweben oder Organen zu entwickeln (Langer und Vacanti, 1993). In den meisten Fällen besteht ein Tissue Engineering Produkt aus drei Hauptkomponenten, dem Biomaterial (Trägermaterial, scaffold), den Zellen und biochemischen Faktoren.
Von Bedeutung ist es, den Einfluss von Biomaterialien auf das Zellverhalten genau zu verstehen und deren Interaktion in in vivo Modellen zu testen.