Proteinreifung und Signaltransduktion bei entzündlichen Prozessen (AG Düsterhöft)
Unser Fokus liegt auf der Untersuchung der membranständigen Protease ADAM17 und ihres wichtigen Interaktors iRhom. Die proteolytische Aktivität des ADAM17-iRhom-Komplexes repräsentiert eine wichtige Schnittstelle für eine Vielzahl von bedeutenden Signalwegen.
Die interzelluläre Kommunikation ist die Grundlage für viele wichtige Prozesse in multizellulären Organismen. In diesem Zusammenhang stellen Wachstumsfaktoren und Zytokine sowie ihre Rezeptoren zwei der wichtigsten interzellulären Kommunikationswege dar. Wachstumsfaktoren sind daran beteiligt, grundlegende Prozesse wie Zellproliferation und -differenzierung zu steuern. Daher sind sie wesentliche Bestandteile der Entwicklung und Regeneration. Die Signaltransduktion durch Zytokine ist in erster Linie mit dem Immunsystem und entzündlichen Prozessen verbunden. Dysfunktionen in diesen Signalwegen verursachen daher schwerwiegende Defekte wie chronische Entzündungen, unzureichende Immunität oder Krebs. Daher ist das reibungslose Funktionieren dieser Signalsysteme und deren Regulation von grundlegender physiologischer Bedeutung.
Ein entscheidender Faktor vieler Signalwege ist die Freisetzung von löslichen, biologisch aktiven Ektodomänen durch proteolytische Prozessierung von membrangebundenen Vorstufen an der Zelloberfläche. Dieser Prozess wird Ectodomain-Shedding genannt und die beteiligten Proteasen werden oft als Sheddasen bezeichnet. Proteolytisch freigesetzte Ektodomänen können entweder Rezeptorliganden oder lösliche Rezeptoren sein und daher entweder agonistische oder antagonistische Signalaktivitäten aufweisen. Die transmembrane Sheddase, a disintegrin- and metalloproteinase (ADAM) 17, prozessiert eine Vielzahl verschiedener Substrate und fungiert damit als Schlüsselregulator in vielen wichtigen physiologischen Prozessen. Zu ihren Substraten gehören Liganden des epidermalen Wachstumsfaktor-Rezeptors (EGFR) sowie verschiedene Zytokine wie der Tumornekrosefaktor (TNF)-α. Diese Vielfalt von Substraten erfordert eine strenge Regulierung der Shedding-Aktivität. Auch wenn bereits viele verschiedene regulatorische Prozesse entdeckt wurden, die ADAM17-Aktivität in Schach halten, sind oft die molekularen Mechanismen nicht komplett verstanden.
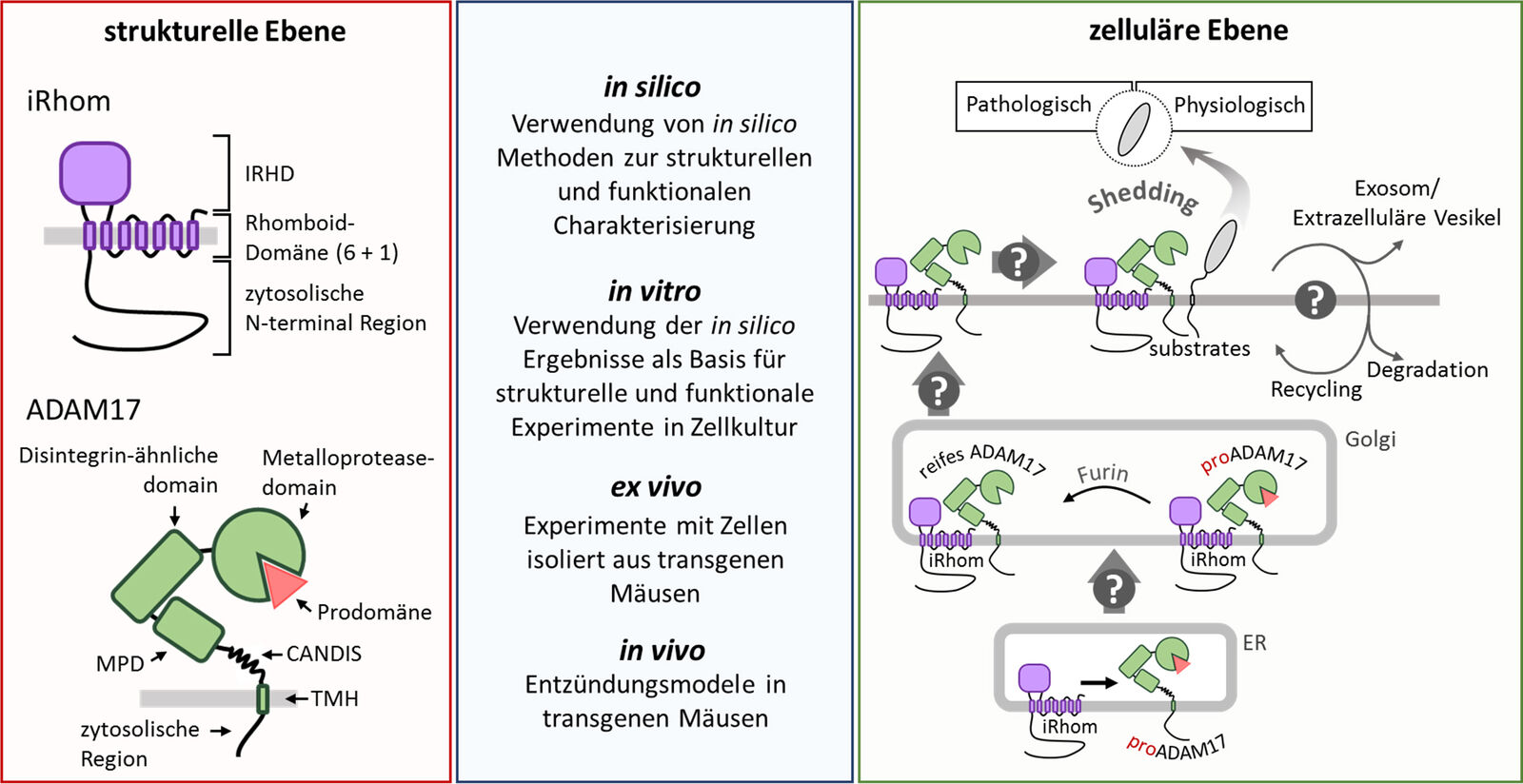
Die multi-transmembranen Pseudoproteasen iRhoms, Mitglieder der Rhomboid-Superfamilie, wurden als unverzichtbare Regulatoren von ADAM17 identifiziert. Sie spielen zwei wichtige, aber getrennte Rollen für die ADAM17-Aktivität. Zum einen ist die Interaktion von ADAM17 mit iRhoms für den Transport vom ER zum Golgi erforderlich, wo ADAM17 vom Zymogen in seine reife Form durch Furin-ähnliche Pro-Protein-Konvertasen umgewandelt wird. Zum andere sind iRhoms direkt an der Regulation des ADAM17-vermittelten Sheddings an der Zelloberfläche beteiligt.
Es gibt noch viele offene Fragen über die zugrundeliegenden molekularen Mechanismen der iRhom-vermittelten Regulation von ADAM17. Unser Forschungsziel ist, die verschiedenen strukturellen Untereinheiten von iRhom zu charakterisieren und dabei deren spezifischen Funktionen zu bestimmen. Zu diesem Zweck kombinieren wir in silico Analysen und Vorhersagen mit verschiedenen in vitro Experimenten, einschließlich verschiedener molekularbiologischer Techniken und zellbiologischer Methoden. Darüber hinaus verwenden wir transgene Mäuse, um die iRhom-vermittelte Regulation von ADAM17 in einem physiologischeren Umfeld zu analysieren, indem wir ex vivo und in vivo Experimente durchführen.
Karriere
Wir sind immer auf der Suche nach motivierten Studenten für Bachelor- und Masterarbeiten sowie für medizinische Doktorarbeiten. Bei Interesse einfach bei Dr. Stefan Düsterhöft (sduesterhoeftukaachende) melden.
- Düsterhöft, S., S. Jung, C. W. Hung, A. Tholey, F. D. Sönnichsen, J. Grötzinger and I. Lorenzen (2013). "Membrane-proximal domain of a disintegrin and metalloprotease-17 represents the putative molecular switch of its shedding activity operated by protein-disulfide isomerase." J Am Chem Soc135(15): 5776-5781.
- Düsterhöft, S., K. Höbel, M. Oldefest, J. Lokau, G. H. Waetzig, A. Chalaris, C. Garbers, J. Scheller, S. Rose-John, I. Lorenzen and J. Grötzinger (2014). "A disintegrin and metalloprotease 17 dynamic interaction sequence, the sweet tooth for the human interleukin 6 receptor." J Biol Chem289(23): 16336-16348.
- Düsterhöft, S., M. Michalek, F. Kordowski, M. Oldefest, A. Sommer, J. Röseler, K. Reiss, J. Grötzinger and I. Lorenzen (2015). "Extracellular Juxtamembrane Segment of ADAM17 Interacts with Membranes and Is Essential for Its Shedding Activity." Biochemistry54(38): 5791-5801.
- Sommer, A., F. Kordowski, J. Buch, T. Maretzky, A. Evers, J. Andra, S. Düsterhöft, M. Michalek, I. Lorenzen, P. Somasundaram, A. Tholey, F. D. Sönnichsen, K. Kunzelmann, L. Heinbockel, C. Nehls, T. Gutsmann, J. Grötzinger, S. Bhakdi and K. Reiss (2016). "Phosphatidylserine exposure is required for ADAM17 sheddase function." Nat Commun7: 11523.
- Lorenzen, I., J. Lokau, Y. Korpys, M. Oldefest, C. M. Flynn, U. Künzel, C. Garbers, M. Freeman, J. Grötzinger and S. Düsterhöft (2016). "Control of ADAM17 activity by regulation of its cellular localisation." Sci Rep6: 35067.
- Düsterhöft S., U. Künzel and M. Freeman (2017) "Rhomboid proteases in human disease: mechanisms and future prospects" Biochim Biophys Acta.1864(11 Pt B): 2200-2209.
- Grötzinger J., I. Lorenzen and S. Düsterhöft (2017)" Molecular insights into the multi-layered regulation of ADAM17: The role of the extracellular region" Biochim Biophys Acta.1864(11 Pt B): 2088-2095.
- Düsterhöft S., J. Lokau and C. Garbers(2019) “The metalloprotease ADAM17 in inflammation and cancer" Pathol Res Pract.6:152410.