Regulation der Entzündung durch mechanische Kräfte (AG Babendreyer)
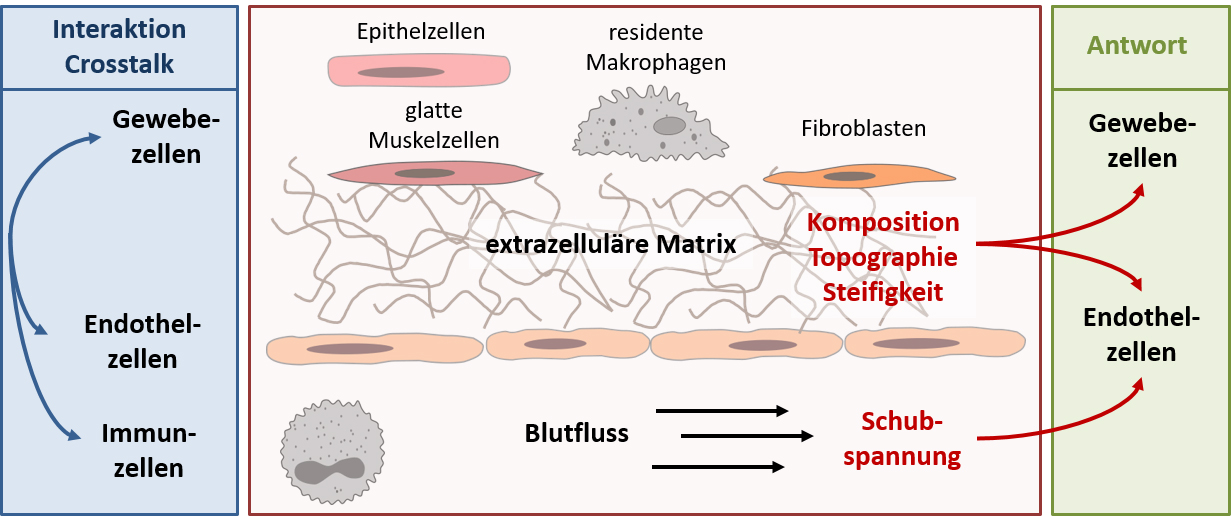
Im Körper sind Zellen dauerhaft verschiedensten mechanischen Kräften ausgesetzt. So sind die blutgefäßauskleidenden Endothelzellen der Reibungskraft des Blutflusses (Schubspannung) ausgesetzt. Des Weiteren stehen Zellen in vivo dauerhaft in Kontakt mit ihrer Umgebung, in der sie wachsen. Abhängig von der Körperregion, die man betrachtet, unterscheidet sich diese Umgebung in der Zusammensetzung und Dichte der dort wachsenden Zelltypen und dem Aufbau der extrazellulären Matrix. Dies sorgt für unterschiedliche mechanische Eigenschaften, wie der Topographie oder der Steifigkeit, in dieser Umgebung. Je nachdem welche mechanischen Kräfte die Zellen wahrnehmen, verändert sich ihr Phänotyp, also ihr Expressionsmuster, die Aktivität verschiedener Signalwege und letzten Endes auch ihre Funktion. Daher ist es nicht verwunderlich, dass es mittels der klassischen in vitro Zellkultur nicht möglich ist, einen physiologischen Phänotyp der Zellen abzubilden. Um dies zu ändern muss verstanden werden, welchen Einfluss die verschiedenen mechanischen Kräfte auf verschiedene Zelltypen haben. Genau an dieser Stelle wollen wir ansetzen. Hierbei liegt unser Fokus auf der Untersuchung mechanischer Kräfte, die in Blutgefäßen eine zentrale Rolle spielen und deren Einfluss auf Entzündungsreaktionen. So ist es unser Ziel die nötigen Grundlagen zu schaffen, um physiologisch relevante in vitro Modelle zur vaskulären Entzündungsforschung zu entwickeln, um im Sinne des 3R-Prinzips (Replacement, Reduction and Refinement) Tierversuche reduzieren zu können und wichtige Grundlagenforschung für die Entwicklung neuer Medizinprodukte, wie endothelialisierten Implantaten, zu liefern.
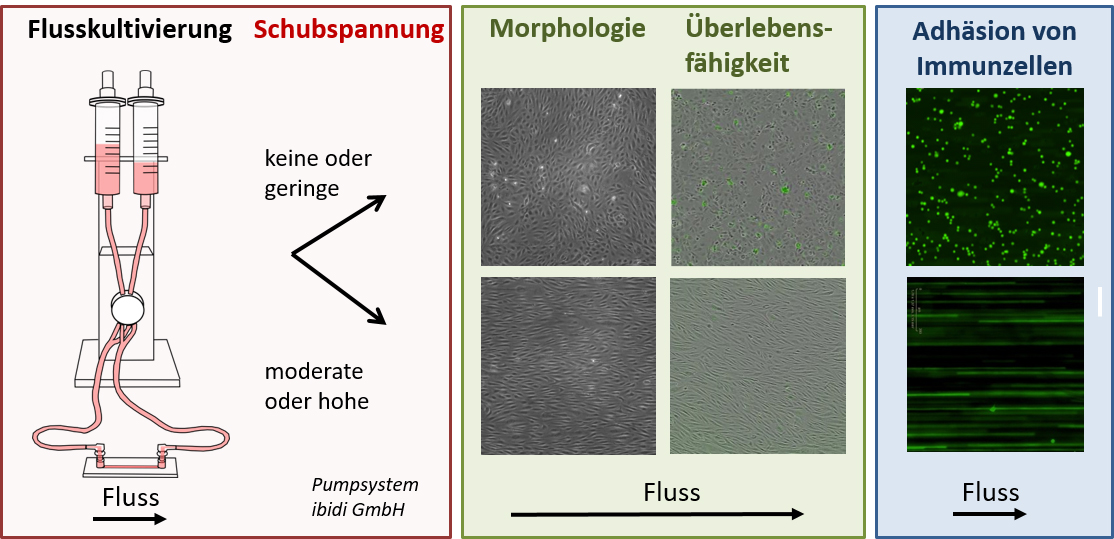
In ersten Studien haben wir den schützenden und anti-entzündlichen Effekt der Flusskultivierung auf primäre Endothelzellen untersucht. Im Zuge unserer Untersuchung konnten wir zeigen, dass Proteasen aus der ADAM-Familie durch Flusskultivierung reguliert werden und durch eine gesteigerte Überlebensfähigkeit der Zellen zum schützenden Effekt beitragen. Darüber hinaus konnten wir zeigen, dass pro-entzündliche Faktoren, wie das membranständige Chemokin CX3CL1, stark herunter reguliert werden. Im Falle von CX3CL1 konnte durch Flusskultivierung nicht nur die basale Expression, sondern auch die durch das pro-entzündliche Cytokin TNF induzierte Expression, stark inhibiert werden. Dies trug dazu bei, dass die durch TNF induzierte Adhäsion von Monozyten auf dem Endothel bei physiologischer Flusskultivierung nahezu vollständig verhindert wurde.
Neben der Flusskultivierung beschäftigen wir uns zunehmend mit dem Einfluss der Substratbeschaffenheit (Komposition, Topographie und Steifigkeit), auf verschiedene vaskuläre Zelltypen (wie Endothelzellen und glatte Muskelzellen). Mittelfristig wollen wir unsere Untersuchungen auf Co-Kulturen ausweiten, um unter Berücksichtigung verschiedener mechanischer Kräfte komplexere Zellkultursysteme zu entwickeln und so ein möglichst physiologisches in vitro System zu schaffen. Hierbei setzen wir auf interdisziplinäre Kooperationen, die eng miteinander in der Graduiertenschule ME3T (www.me3t.rwth-aachen.de) verbunden sind.
Karriere
Wir sind immer auf der Suche nach motivierten Studenten für Bachelor- und Masterarbeiten sowie für medizinische Doktorarbeiten. Bei Interesse einfach bei Dr. Aaron Babendreyer (ababendreyerukaachende) melden.
Publikationen
- Differential Regulation of Lung Endothelial Permeability in Vitro and in Situ.
Uhlig, S., Yang, Y., Waade, J., Wittenberg, C., Babendreyer, A. and Kuebler, W. M. (2014). Cell. Physiol. Biochem. 34:1-19. - Shear Stress Counteracts Endothelial CX3CL1 Induction and Monocyte Cell Adhesion.
Babendreyer, A., Molls, L., Dreymueller, D., Uhlig, S. and Ludwig, A. (2017). Mediators Inflamm. 2017:1515389. - The metalloproteinase ADAM15 is upregulated by shear stress and promotes survival of endothelial cells.
Babendreyer, A., Molls, L., Simons, I., Dreymueller, D., Jahr, H., Denecke, B., Boon, R. A., Bette, S., Schnakenberg, U. and Ludwig, A. (2018). Submitted manuscript.