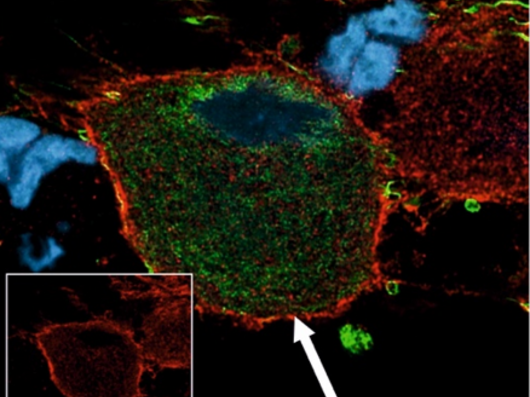
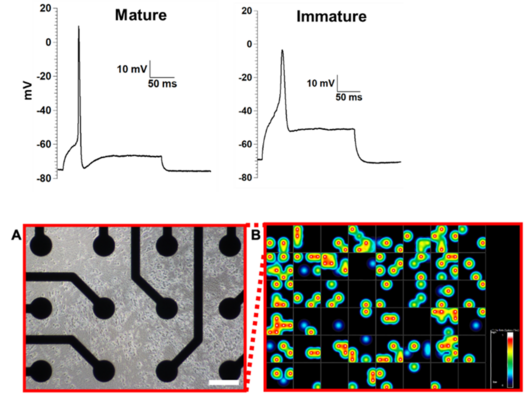
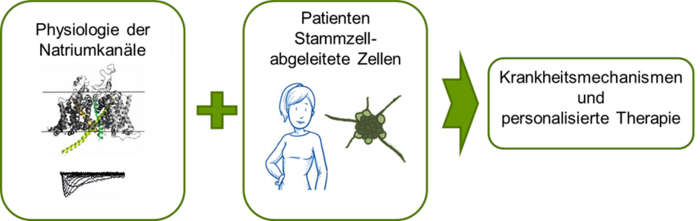
Institut für Neurophysiologie
Das Institut für Neurophysiologie ist eines der zurzeit zwei Physiologischen Institute. Das dritte Institut ist aktuell nicht besetzt. In einem internationalen Team aus Wissenschaftlern verschiedener Sparten befassen wir uns mit Natriumkanälen und der Erregbarkeit von Zellen, insbesondere auch mit dem Zusammenhang von Natriumkanälen und Schmerz. Da Natriumkanäle wesentlich für Nervenerregung verantwortlich sind, lassen sich durch Veränderungen dieser Natriumkanäle möglicherweise Schmerzen verhindern.
Auf unserer Website finden Sie alles Wissenswerte zu unserer Forschung, sowie Informationen über Offene Stellen.
Einen Überblick über die Lehre und Geschichte des Instituts finden Sie auf der Seite der Physiologischen Institute.
Bei Fragen oder Wünschen sprechen Sie uns gerne an.
Aktuelles und Veranstaltungskalender

Neue Sprecherin für Translationale Neurowissenschaften
Univ.-Prof. Angelika Lampert ist die neue Sprecherin des Forschungsschwerpunkts Translationale Neurowissenschaften an der Medizinischen Fakultät der RWTH Aachen. Die Leiterin des Instituts für…