AG Prof. Stefan Gründer
Schwerpunkt unserer Forschung sind Ionenkanäle. Ionenkanäle sind die Grundlage der Erregbarkeit von Neuronen und der Kommunikation von Neuronen miteinander. Mutationen in Ionenkanälen können Krankheiten auslösen und eine Fehlregulation von Ionenkanälen bestimmt das klinische Bild vieler Krankheiten. Die detaillierte molekulare Analyse von Ionenkanälen trägt zu einem besseren Verständnis ihrer pathophysiologischen Rolle bei und ist Grundlage für eine gezielte Pharmakotherapie.
Gegenwärtig liegt unser Fokus auf Ionenkanälen der DEG/ENaC Genfamilie. Dabei interessieren uns besonders 3 Unterfamilien, die eng miteinander verwandte Ionenkanäle umfassen und durch 3 verschiedene Liganden aktiviert werden:
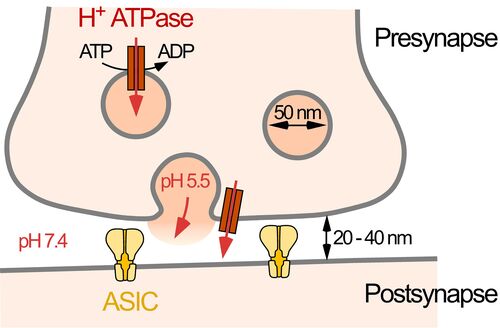
Protonen-aktivierte Ionenkanäle (Acid-sensing ion channels, ASICs) sind wichtige Rezeptoren für extrazelluläre Protonen; sie sind weit verbreitet in Neuronen des zentralen und peripheren Nervensystems. ASICs sind an der synaptischen Transmission und der sensorischen Transduktion beteiligt. Protonen reichern sich auch bei einer Ischämie an und die Aktivierung von ASICs trägt zur Angina pectoris und zum Zelltod beim ischämischen Schlaganfall wesentlich bei. Außerdem tragen ASICs zur axonalen Degeneration in einem Tiermodell für Multiple Sklerose bei. ASICs haben also weit reichende physiologische und pathophysiologische Bedeutung. Ihre Aktivierung und Regulation genau zu verstehen, ist daher von großer Relevanz. Aktuell konzentrieren wir uns darauf, das ASIC1a-Proteom - ASIC1a und seine eng interagierenden Hilfsproteine - zu charakterisieren.
Drei wichtige Publikationen unserer AG zum Thema:
- Bartoi T, Augustinowski K, Polleichtner G, Gründer S, und Ulbrich MH (2014) Acid-sensing ion channel (ASIC) 1a/2a heteromers have a flexible 2:1/1:2 stoichimetry. Proc. Natl. Acad. Sci. USA, 111, 8281-8286
- Reimers C, Lee C-H, Kalbacher H, Tian Y, Hung C-H, Schmidt A, Prokop L, Kauferstein S, Mebs D, Cheng C-C and Gründer S (2017) Identification of a cono-RFamide from the venom of Conus textile that targets ASIC3 and enhances muscle pain. Proc. Natl. Acad. Sci. USA 114(17), E3507-E3515
- Fischer L, Schmidt A, Dopychai A, Joussen S, Joeres N, Oslender-Bujotzek A, Schmalzing G, and Gründer S (2023) Physiologically relevant acid-sensing ion channel (ASIC) 2a/3 heteromers have a 1:2 stoichiometry. Commun. Biol., 6(1): 701
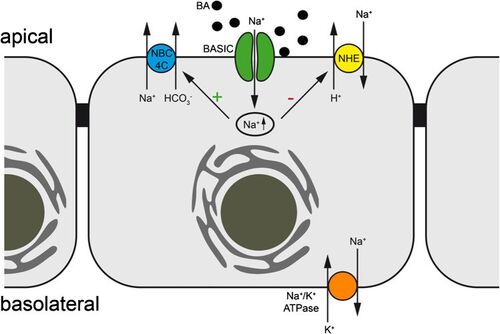
Der Gallensalz-sensitive Ionenkanal (bile acid-sensitive ion channel, BASIC) ist ein noch wenig charakterisierter Ionenkanal, der u.a. in Gallengängen exprimiert wird und direkt durch Gallensalze aktiviert wird. BASIC ist in den Gallengängen und im Dünndarm möglicherweise am Na+-Transport beteiligt. Damit hat er potenzielle Bedeutung bei Diarrhoe und der Cholestase. Außerdem kommt er im Gehirn vor, wo er noch völlig unbekannte Funktionen hat. Aktuell untersuchen wir die Rolle von BASIC in der Leber, dem Pankreas und dem Darm.
Drei wichtige Publikationen unserer AG zum Thema:
- Wiemuth D, Sahin H, Falkenburger BH, Lefèvre C, Wasmuth HE und Gründer S (2012) BASIC - a bile acid-sensitive ion channel highly expressed in bile ducts.FASEB J., 26, 4122-4130
- Schmidt A, Löhrer D, Alsop RJ, Lenzig P, Oslender-Bujotzek A, Wirtz M, Rheinstädter MC, Gründer S, and Wiemuth D (2016) A cytosolic amphiphilic alpha helix controls the activity of the Bile Acid Sensitive Ion Channel BASIC.J. Biol. Chem. 291(47): 24551-24565
- Wiegreffe S, Löhrer D, Wirtz M, and Wiemuth D (2021) The bile acid-sensitive ion channel (BASIC) mediates bile acid-dependent currents in bile duct epithelial cells. Pflügers Arch. 473(12): 1841–1850
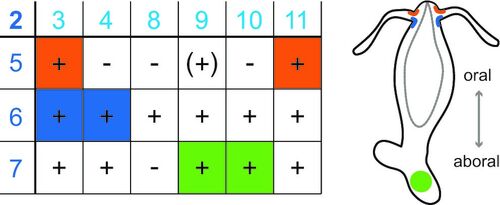
Peptid-aktivierte Ionenkanäle sind bisher nur sehr wenig untersucht. Ein biologisches Dogma besagt, dass Peptide nur G-Protein-gekoppelte Rezeptoren aktivieren. Uns ist es gelungen, eine Gruppe von Peptid-aktivierten Ionenkanälen aus einem einfachen Modellorganismus (dem Süßwasserpolypen Hydra magnipapillata) zu isolieren, die Hydra Na+-Kanäle (HyNaCs). Dies zeigt, dass Neuropeptide schon in einfachen Nervensystemen für die schnelle Neurotransmission genutzt wurden. Neuropeptide sind auch beim Menschen weit verbreitet und ASICs werden durch Neuropeptide moduliert. Wir untersuchen HyNaCs als Modellkanal, um die Neurotransmission in einem einfachen Nervensystem besser zu verstehen und um konservierte Eigenschaften der eng verwandten ASICs und des BASIC zu identifizieren.
Drei wichtige Publikationen unserer AG zum Thema:
- Golubovic A, Kuhn A, Williamson M, Kalbacher H, Holstein TW, Grimmelikhuijzen CJ und Gründer S (2007) A peptide-gated ion channel from the freshwater polyp Hydra.J. Biol. Chem. 282: 35098-35103
- Assmann M, Kuhn A, Dürrnagel S, Holstein TW and Gründer S (2014) The comprehensive analysis of DEG/ENaC subunits in Hydra reveals a large variety of peptide-gated channels, potentially involved in neuromuscular transmission. BMC Biology 12: 84
- Schmidt A, Bauknecht P, Williams EA, Augustinowski K, Gründer S*, and Jékely G* (2018) Dual signaling of Wamide myoinhibitory peptides through a peptide-gated channel and a GPCR in Platynereis. FASEB J. 32: 5338-5349
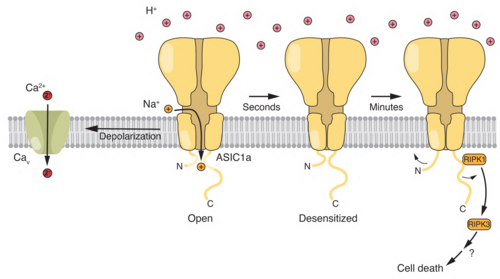
Darüber hinaus untersuchen wir die Rolle von Ionenkanälen und von Säure-Basen-Transportern in Hirntumoren, wie Glioblastom und Medulloblastom.
Drei wichtige Publikationen unserer AG zum Thema:
1) Tian Y, Bresenitz P, Reska A, El Moussaoui L, Beier C and Gründer S (2017) Glioblastoma cancer stem cell lines express functional acid sensing ion channels ASIC1a and ASIC3. Sci. Rep. 7: 13674
2) Clusmann J, Franco KC, Suárez DAC, Katona I, Minguez MG, Boersch N, Pissas KP, Vanek J, Tian Y, and Gründer S (2022) Acidosis induces RIPK1-dependent death of glioblastoma stem cells via acid-sensing ion channel 1a. Cell Death Dis., 13(8): 702
3) Cortés Franco KD, Brakmann IC, Feoktistova M, Panayotova-Dimitrova D, Gründer S, and Tian, Y (2023) Aggressive migration in acidic pH of a glioblastoma cancer stem cell line in vitro is independent of ASIC and KCa3.1 ion channels, but involves phosphoinositide 3-kinase. Pflügers Arch., 475(3): 405-416




