Unsere Forschung
Im Zentrum unseres Interesses steht die Interaktion zwischen kommensalen und pathogenen Mikroorganismen und den das Darmlumen auskleidenden Darmepithelzellen. Ursprünglich dachte man, dass diese Zellen im Wesentlichen eine physikalische Barriere zwischen dem Wirtsgewebe und dem von Mikroorganismen besiedelten Darmlumen bilden. Heute wissen wir, dass diese Zellen aktiv dazu beitragen, unter homöostatischen Bedingungen das Gleichgewicht zwischen Bakterien und Wirt zu erhalten und früh während einer Infektion, die Immunabwehr zu stimulieren. Die Interaktion zwischen Mikroorganismen und Darmepithelzellen basiert auf dem sogenannten angeborenen Immunsystem. Das angeborene Immunsystem ermöglicht eine unmittelbare Erkennung und rasche Reaktion des Wirtes auf eine Infektion. Bei der Erkennung der Erreger spielen sogenannte pattern recognition receptors (PRR) eine wichtige Rolle. Sie bilden eine heterogene Gruppe von Rezeptoren auf der Zelloberfläche, aber auch im Zellinneren, die evolutionär konservierte mikrobielle Strukturen wie z. B. Lipopolysaccharid bei Gram-negativen Bakterien erkennen und die Wirtsabwehr aktivieren. Eine Möglichkeit des Wirtes, eine Störung der Epithelzellbarriere oder eine Infektion zu verhindern, ist die Produktion von antimikrobiellen Peptiden. Diese kurzen Proteine stellen eine Art „körpereigene Antibiotika“ dar und sind in der Lage, Bakterien, manche Viren und sogar Parasiten abzutöten. Sie gehören damit zu den Abwehrmechanismen des angeborenen Immunsystems. Seit einigen Jahren interessiert uns besonders die Situation im Darm von Neugeborenen. Neugeborene werden steril geboren; erst nach Geburt wird die Darmschleimhaut von kommensalen Bakterien besiedelt. Weitgehend unklar ist aber, warum das angeborene Immunsystem des Neugeborenen während der Besiedlung nach Geburt keine Entzündungsreaktion auslöst und wie es zur Ausbildung stabilen Wirts-Bakterien-Homöostase und einer reifen Darmflora kommt. Auch lösen beim Neugeborenen eine Reihe von pathogenen Mikroorganismen Infektionen aus, die beim erwachsenen Wirt nicht pathogen sind oder ein ganz anderes Krankheitsbild verursachen. Dies deutet darauf hin, dass die Interaktion zwischen Mikroorganismen und Wirt beim Neugeborenen ganz anderen Regeln als beim Erwachsenen unterliegt. Ein besseres Verständnis des Immunsystems beim Neugeborenen könnte damit helfen, die Therapie von Infektionen zu verbessern. Zudem ist interessant, dass die frühe Lebensphase für die Ausbildung des Immunsystems und damit die lebenslange Interaktion mit mikrobiellen Erregern und Strukturen wichtig zu sein scheint. Erste Daten deuten darauf hin, dass früh nach Geburt eine „Prägung“ des Immunsystems stattfindet, die lebenslang die Wirts-Mikroben Interaktion beeinflusst und z. B. einen Einfluss auf die Empfindlichkeit gegenüber Allergien haben könnte.
Schwerpunkte unserer Arbeit
Rezeptoren des angeborenen Immunsystems ermöglichen die Erkennung von konservierten molekularen Strukturen von Bakterien, Pilzen, Viren und Parasiten. Eine Stimulation der Rezeptoren induziert die rasche Aktivierung des Immunsystems z.B. durch die Sekretion von Chemokinen und Zytokinen und damit die Rekrutierung von professionellen Phagozyten. Im Fall einer lokalen Infektion kann dies zur frühzeitigen Elimination des Erregers führen und ein weiteres Fortschreiten der Erregerausbreitung im Wirt verhindern. Eine überschießende unkontrollierte Stimulation des angeborenen Immunsystems oder eine Aktivierung in der Abwesenheit eines Infektionserregers kann, auf der anderen Seite, zu chronischen Entzündung und damit zur Krankheitsentstehung beitragen. Epithelzellen bilden die oberste Zellschicht der Darmschleimhaut, die beim erwachsenen Wirtsorganismus durch eine dichte und vielfältige bakterielle Flora (Mikrobiota) besiedelt ist. Die anatomische Lokalisation der Epithelzellen an der Grenzfläche zwischen sterilem Wirtsgewebe und dem bakteriell besiedeltem und mit Nahrungsbestandteilen exponiertem Darmlumen erfordert eine strikte Kontrolle der Stimulation von Immunrezeptoren, um eine ungewollte, gewebezerstörende Reaktion des Immunsystems zu verhindern. Auf der anderen Seite ist der Darm das Ziel vieler pathogener Mikroorganismen; eine frühzeitige Erkennung und Elimination kann deshalb zur Vermeidung von Infektionen beitragen. Schon früh konnten wir die Expression von Toll-like Rezeptor (TLR)4, dem Rezeptor für bakterielles Lipopolysaccharid (LPS) durch Darmepithelzellen zeigen (Hornef et al., 2002) und Besonderheiten der zellulären Lokalisation für die Ligandenerkennung strukturell und funktionell charakterisieren (Hornef et al., 2003; Duerr et al., 2009). Beim gesunden Erwachsenen trägt eine kontrollierte Stimulation von epithelialen TLRs zur Aufrechterhaltung der Darmhomöostase bei (Stockinger et al., 2014). Jedoch findet sich im adulten Wirt nach einer Gewebeischämie durch SUMOylierung und einen Wechsel der Ubiquitinierung (K48 zu K63) eine vermehrte epitheliale Expression des Signalmoleküls interleukin 1 associated kinase (IRAK)1. Die erhöhten IRAK1 Spiegel vermitteln eine postischämische Überempfindlichkeit gegenüber mikrobiellen Liganden und tragen zur Gewebeschädigung nach transienter Gewebehypoxie bei (Chassin et al., EMBO Mol Med, 2012). Der Rezeptor für doppelsträngige RNA, TLR3, kooperiert mit den Helikasen RigI und MDA-5 bei der Erkennung von pathogenen dsRNA Viren. Diese Rezeptoren induzieren die Sekretion von Interferonen, die Zellen gegenüber einer Virusinfektion unempfindlich machen. Bei Untersuchungen zur epithelialen Immun- antwort auf eine Rotavirusinfektion konnten wir erstmals die besondere Bedeutung von Interferon-λ für die antivirale Wirtsantwort des Darmepithels zeigen (Pott et al., 2011).
Eine Infektion mit Listeria monozytogenes stimuliert nach Lyse der endosomalen Membran in Darmepithelzellen Nod2, den im Zytosol lokalisierten Rezeptor für Muramyl Dipeptid (MDP) aus der bakteriellen Peptidoglycanschicht. Mithilfe Einzelzellanalyse konnten wir die überraschende Beobachtung machen, dass trotz der Invasions-abhängigen Aktivierung von Darmepithelzellen v.a. nicht infizierte, Listeria-negative Epithelzellen Chemokine produzierten. Weitere Analysen bestätigten die Kommunikation zwischen Darmepithelzellen mittels durch die NADPH Oxidase (NOX)4 produzierten Sauerstoffradikalen. Damit konnte ein neuer Mechanismus der Informationsweitergabe an benachbarte Darmepithelzellen nach bakterieller Infektion gezeigt werden (Dolowschiak et al., 2010).
Ausgewählte Arbeiten
Hornef MW, Frisan T, Vandewalle A, Normark S, Richter-Dahlfors A. Toll-like receptor 4 resides in the Golgi apparatus and colocalizes with internalized lipopolysaccharide in intestinal epithelial cells. J Exp Med. 2002; 195(5): 559-70.
Hornef MW, Normark BH, Vandewalle A, Normark S. Intracellular recognition of lipopolysaccharide by toll-like receptor 4 in intestinal epithelial cells. J Exp Med. 2003; 198(8): 1225-35.
Duerr CU, Zenk SF, Chassin C, Pott J, Gütle D, Hensel M, Hornef MW. O-antigen delays lipopolysaccharide recognition and impairs antibacterial host defense in murine intestinal epithelial cells. PLoS Pathog. 2009 ;5(9): e1000567.
Dolowschiak, T., Chassin, C., Ben Mkaddem, S., Fuchs, T.M., Weiss, S., Vandewalle, A., Hornef, M.W.. Potentiation of epithelial innate host responses by intercellular communication. PLoS Pathogens 6: e1001194, 2010.
Pott, J., MahlakoÞiv, T., Mordstein, M., Duerr, C.U., Michiels, T., Stockinger, S.*, Staeheli, P.*, Hornef, M.W.*. IFN- determines the intestinal epithelial antiviral host defense. Proc Natl Acad Sci U S A. 108: 7944-9, 2011.
Chassin C, Hempel C, Stockinger S, Dupont A, Kübler JF, Wedemeyer J, Vandewalle A, Hornef MW. MicroRNA-146a-mediated downregulation of IRAK1 protects mouse and human small intestine against ischemia/reperfusion injury. EMBO Mol Med. 4(12):1308- 19, 2012
Fulde, M., Hornef, M.W. Maturation of the mucosal innate immune system during the postnatal period. Rev Immunol. 260: 21-34, 2014.
Stockinger, S., Duerr, CU., Fulde,, M., Dolowschiak, T., Pott, J., Yang, I., Eibach, D., Bäckhed, F., Akira, S., Suerbaum, S., Brugman, M., Hornef, M.W. TRIF Signaling Drives Homeostatic Intestinal Epithelial Antimicrobial Peptide Expression. J Immunol. 193: 4223-34, 2014.
Ein zweiter Schwerpunkt unserer Arbeiten liegt auf der Analyse der intestinalen epithelialen Wirtsabwehr. Im Zentrum unseres Interesses stehen dabei die Produktion und Regulation enterischer antimikrobieller Peptide. Paneth-Zellen am Grund intestinaler Krypten produzieren und sekretieren eine große Menge und Vielfalt enterischer antimikobieller Peptide wie -Defensine und cryptdin related sequence (CRS)-Peptide. Diese vom Körper selbst hergestellten Antibiotika- ähnlichen Substanzen scheinen eine wichtige Rolle bei der mukosalen Wirstabwehr, aber auch bei der Regulation der enterischen Mikrobiota zu spielen. In weiteren Arbeiten konnten wir zeigen, das CRS Peptide sich aus Peptid-Homo- oder Heterodimeren zusammensetzten. Dieser Mechanismus erhöht die Variabilität des Peptid-Repertoires und könnte wichtig sein, um gegen alle potentiell gefährlichen Bakterien eine wirksame Abwehr bilden zu können (Hornef et al., 2004). Die Sekretion von antimikrobiellen Peptiden durch Paneth Zellen wird durch neuronale Stimuli (Parasympatiko- mimetika) und mikrobielle Stimuli (MDP) induziert. Neuere Arbeiten an isolierten Darmkrypten identifizierten kürzlich auch endogene Mediatoren wie IL-4 und IL-13 als Stimuli für die Degranulation von Paneth Zellen und die Freisetzung von enterischen antimikrobiellen Peptiden (Stockinger et al., 2014a). Die Bildung von Paneth Zellen unterliegt homöostatischen Signalen des angeborenen Immunsystems. So konnten wir zeigen, dass TLR3 und TRIF unter homöostatischen Bedingungen zur Bildung von Paneth Zellen und damit zur Produktion von antimikrobiellen Peptiden beitragen (Stockinger et al., 2014b).
Nach Sekretion finden sich antimikrobielle Peptide angereichert in der Mukusschicht wieder. Sie bilden dort eine physico- chemische Barriere, die die Penetration von Bakterien hemmt. Darüberhinaus inhibieren sie auch die Stimulation durch mikrobielle Liganden und ermöglichen so die Elimination von Bakterien in der Abwesenheit einer Immunstimulation und tragen zur mukosalen epithelialen Homöostase bei (Meyer Hoffert et al., 2008; Dupont et al., 2014). In einer systematischen Studie zur Expression verschiedener antimikrobieller Peptide während der postnatalen Entwicklung konnten wir zeigen, dass die bekannten enterischen Peptide, alpha-Defensine und CRS Peptide erst zwei Wochen nach Geburt in signifikanten Mengen produziert werden. Während der ersten zwei Lebenswochen schützt ein Peptid einer anderen Familie, das cathelicidin-related antimicrobial peptide (CRAMP) das neugeborene Darmepithel.
Dieser Wechsel des Peptid-Repertoires könnte wichtig sein, um die Etablierung der Darmflora beim neugeborenen Wirt zu ermöglichen (Menard et al., 2008).
Ausgewählte Arbeiten
Hornef MW, Putsep K, Karlsson J, Refai E, Andersson M. Increased diversity of intestinal antimicrobial peptides by covalent dimer formation. Nat Immunol. 2004 Aug;5(8):836-43.
Meìnard S, Förster V, Lotz M, Gütle D, Duerr CU, Gallo RL, Henriques-Normark B, Pütsep K, Andersson M, Glocker EO, Hornef MW. Developmental switch of intestinal antimicrobial peptide expression. J Exp Med. 2008; 205(1): 183-93.
Meyer-Hoffert U, Hornef MW, Henriques-Normark B, Axelsson LG, Midtvedt T, Pütsep K, Andersson M. Secreted enteric antimicrobial activity localises to the mucus surface layer. Gut. 2008; 57(6): 764-71.
Stockinger S, Albers T, Duerr CU, Meìnard S, Pütsep K, Andersson M, Hornef MW. Interleukin-
13-mediated paneth cell degranulation and antimicrobial peptide release. J Innate Immun. 2014;6(4):530-41.
Stockinger, S., Dolowschiak, T., Duerr, C.U., Pott, J., Eibach, D., Bäckhed, F., Suerbaum, S., Brugman, M., Hornef, M.W. TRIF determines intestinal epitelial homeostasis but is compensated during mucosal repair. J Immunol. 193: 4223-34, 2014.
Dupont A, Kaconis Y, Yang I, Albers T, Woltemate S, Heinbockel L, Andersson M, Suerbaum S, Brandenburg K, Hornef MW. Intestinal mucus affinity and biological activity of an orally administered antibacterial and anti-inflammatory peptide. Gut, 64: 222-32, 2015.
Mit der Geburt beginnt die bakterielle Besiedlung des Darmes, die beim Menschen nach einigen Monaten bis Jahren zur Etablierung einer komplexen und dynamischen enterischen Mikrobiota, aber auch einer homöostatischen Wirts-Bakterien Interaktion führt. Darmepithelzellen exprimieren Rezeptoren des angeborenen Immunsystems und sind in der Lage, auf die Exposition mit mikrobiellen Stimuli, eine entzündliche Reaktion hervorzurufen. Warum diese während der frühen Phase der Besiedlung nicht (über)reagieren ist nur unvollständig verstanden. Eigene Arbeiten zeigen, dass sowohl adaptive als auch entwicklungsbiologisch regulierte Mechanismen eine überschießende Reaktion des mukosalen angeborenen Immunsystem im Darm nach Geburt verhindern. So konnten wir zeigen, dass Darmepithelzellen kurz nach Geburt einen adaptiven Prozess durchlaufen, der die Aktivierung von TLR4 während der ersten Tage nach Geburt hemmt und damit eine ungewollte Stimulation und epitheliale Apoptose während der postnatalen bakteriellen Kolonisierung der Darmmukosa verhindert (Lotz et al., 2006). Eine microRNA-vermittelte Translationsinhibition sowie die proteosomale Degradation des Signalmoleküls interleukin 1 receptor associated kinase (IRAK)1 verursachen diese adaptive Tolerisierung des Darmepithels nach Geburt und schützen es vor einer ungewollten Immunstimulation während der Etablierung der Darmflora (Chassin et al., 2010). Ein Beispiel für die entwicklungsbiologische Regulation der Immunerkennung ist die verminderte Expression von TLR3, dem Rezeptor für doppelsträngige RNA, im neonatalen Darm. Die reduzierte TLR3 Expression trägt dazu bei, dass der neugeborene Wirt gegenüber einer Infektion mit Rotaviren eine deutlich erhöhte Empfindlichkeit zeigt (Pott et al., 2012). Auch gegenüber anderen Infektionserregern ist der neugeborene Organismus empfindlicher: So führt eine orale Exposition Neugeborener mit enteropathogenen Bakterien wie z.B. Salmonella enterica wegen der niedrigen Diversität der Darmflora zu einer raschen Kolonisierung des Darmes. Im weiteren Verlauf findet sich im neugeborenen Wirt überraschenderweise eine Salmonella pathogenicity island (SPI)1-abhängige Invasion von Darmepithelzellen und die Ausbildung von intraepithelialen Mikrokolonien. Diese Strukturen wurden zuvor v.a. nach Infektion von Zellkulturen beobachtet. Mit diesen Arbeiten konnten wir erstmals ein leicht zugängliches in vivo Modell zur Analyse der Salmonella/Epithelzell- Interaktion etablieren (Zhang et al., 2014).
Auch das adaptive Immunsystem unterliegt während der Zeit nach Geburt einer besonderen Regulation. Klassische TCRαβ T Zellen besiedeln die Peyer’s Patches schon wenige Stunden nach Geburt, bleiben jedoch trotz Etablierung der Mikrobiota and Kontakt mit Nahrungsantigenen unreif. Verantwortlich dafür sind zum einen mütterliche Immunglobuline (IgA) zum anderen kindliche regulatorische T Zellen (Torow et al., 2015).
Ausgewählte Literatur
Lotz, M., Gütle, D., Meìnard, S., Walther, S., Bogdan, C., Hornef, M.W. Postnatal acquisition of endotoxin tolerance in intestinal epithelial cells. J Exp Med. 2006; 203(4): 973-84.
Chassin, C., Kocur, M., Pott, J., Duerr, C.U., Gütle, D., Lotz, M., Hornef, M.W. miR-146a mediates protective innate immune tolerance in the neonate intestine. Cell Host Microbe 2010, 8: 358-68.
Pott J, Stockinger S, Torow N, Smoczek A, Lindner C, McInerney G, Bäckhed F, Baumann U, Pabst O, Bleich A, Hornef MW. Age-dependent TLR3 expression of the intestinal epithelium contributes to rotavirus susceptibility. PLoS Pathogens, 8(5):e1002670. 2012
Zhang, K., Dupont, A., Torow, N., Gohde, F., Leschner, S., Lienenklaus, S., Weiss, S., Brinkmann, M.M., Kühnel, M., Hensel, M., Fulde., M.*, Hornef, M.W. Age-dependent enterocyte invasion and microcolony formation by Salmonella. PLoS Pathog. 10(9): e1004385, 2014.
Torow, N., Yu, K., Hassani, K., Bleich, A., Lochner, M., Brenneke, A., Weiss, S., Förster, R., Pabst, O., Hornef, M.-W. Active suppression of intestinal CD4+TCRαβ+ T lymphocyte maturation during the postnatal period. Nat Commun. 6: 7725, 2015.
Dupont, A., Litvak, Y., Zhang, K., Bleich A., Fulde, M., Rosenshine, I., Hornef M.W. Oral enteropathogenic E. coli (EPEC) infection of newborn mice. PLoS Pathogens, doi: 10.1371/journal.ppat.1005616
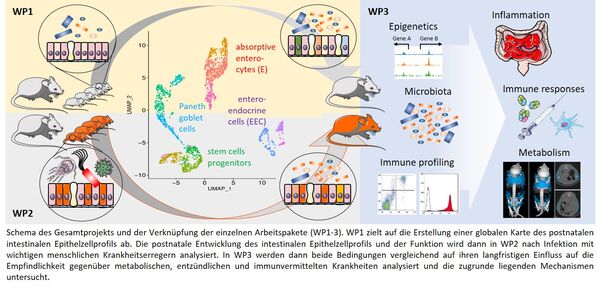
Infektionen des Magen-Darm-Trakts und ihre langfristigen Folgen sind nach wie vor eine der Hauptursachen für Mortalität und Morbidität im Kindesalter weltweit. Darüber hinaus gilt das frühkindliche Zeitfenster, in dem das Schleimhautgewebe ausgebildet und das Darmmikrobiom etabliert wird, als kritisches und nicht redundantes Zeitfenster das das Risiko für die Entwicklung entzündlicher, immunvermittelter und metabolischer Krankheiten bestimmt. Drei Faktoren, das Darmmikrobiom, das Immunsystem der Schleimhaut und die Epithelbarriere, wirken zusammen, um nach Geburt die intestinale Wirts-Mikroben Homöostase zu etablieren. Die Reifung des Schleimhautimmunsystems und die Etablierung des Darmmikrobioms wurden in der Vergangenheit bereits umfassend untersucht. Die postnatale Entwicklung der Heterogenität und funktionellen Spezialisierung von Epithelzellen sowie der Einfluss von Infektionen wurden jedoch noch wenig untersucht. Mit EarlyLife nutzen wir innovative, mehrdimensionale Analyseansätze, um anhand neuartiger in-vivo-Modelle den ersten umfassenden Überblick über die postnatale epitheliale Zelltypen- und Subtypendifferenzierung zu bekommen und die Auswirkungen einer Infektion durch wichtige humane bakterielle, virale und parasitäre Krankheitserreger zu untersuchen. Langfristige entzündliche, immunvermittelte und metabolische Auswirkungen werden mit Hilfe der Erstellung epigenetischer Profile, Mikrobiota-Transferexperimenten, Stammzellorganoidkulturen und genetischen Modellen funktionell untersucht. Die identifizierten Mechanismen werden durch Einzelzellanalysen aus Schleimhautbiopsien, Stammzellorganoide und Transkriptomuntersuchungen aus menschlichen Stuhlproben bestätigt. Als Ergebnis erwarten wir, Mechanismen der erhöhten Infektionsanfälligkeit von Neugeborenen zu identifizieren, den wichtigen und nicht redundanten Einfluss der postnatalen Periode auf die mukosale Homöostase besser zu verstehen und die Rolle der frühkindlichen Prägung für langfristige immunvermittelte, entzündliche und metabolische Erkrankungen zu identifizieren.
Reviews zum Nachlesen
Renz, H, Brandtzaeg, P, Hornef, MW. The impact of perinatal immune development on mucosal homeostasis and chronic inflammation. Nat Rev Immunol. 12:9-23, 2011
Pott, J., Hornef, M.W. Innate immune signalling at the intestinal epithelium in homeostasis and disease. EMBO Rep, 13(8):684-98, 2012
Fulde, M., Hornef, M.W. Maturation of the mucosal innate immune system during the postnatal period. Rev Immunol. 260: 21-34, 2014
Dupont, A., Heinbockel, L., Brandenburg, K., Hornef, M.W. Antimicrobial peptides and the enteric mucus layer act in concert to protect the intestinal mucosa. Gut Microbes. 5: 761-5, 2014
Zhang K, Hornef MW, Dupont A. The intestinal epithelium as guardian of gut barrier integrity. Cell Microbiol. 17(11):1561-9, 2015.
van Best N, Hornef MW, Savelkoul PH, Penders J. On the origin of species: Factors shaping the establishment of infant's gut microbiota. Birth Defects Res C Embryo Today. 105(4):240-51, 2015.
Hornef MW, Pabst O. Real friends: Faecalibacterium prausnitzii supports mucosal immune homeostasis. Gut. 65(3):365-7, 2016.
Pabst, O., Cerovic, V., Hornef, M.W. Secretory IgA coordinates establishment and maintenance of the microbiota. Trends Immunol. pii: S1471-4906(16)00040-5, 2016.